همان طور که در پست سلولهای الکتروشیمی آموختیم، سلولهای الکترولیتی دارای باتری بوده و فقط یک محلول الکترولیت دارند (برخلاف سلولهای گالوانی که دو محلول الکترولیت متفاوت داشتند) و در سلول الکترولیتی، دیگر خبری از پل نمکی یا دیوار متخلخل نیست، مطابق شکل زیر که در آن برقکافت سدیم کلرید را مشاهده میکنیم:
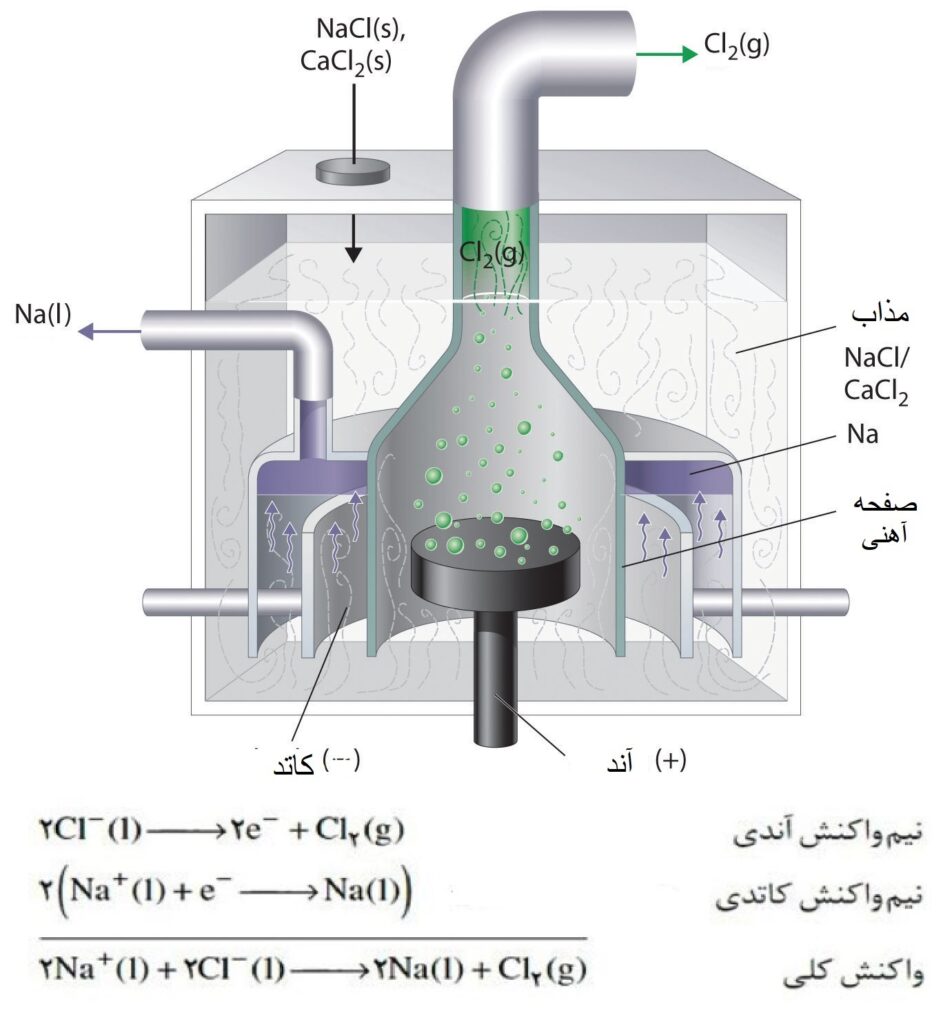
مطابق شکل بالا، وقتی یک ترکیب یونی به حالت مذاب درمیآید به یونهای سازنده خود تجزیه میشود، پس سدیم کلرید مذاب به حالت یون سدیم (+Na) و یون کلر (–Cl) موجود است.
حال یون کلر (–Cl) برای خنثی شدن باید الکترون از دست بدهد تا به گاز کار (Cl2) تبدیل شود، پس نیم واکنش آندی برقکافت NaCl به صورت زیر میباشد:
Cl–(aq)→Cl2(g)+e
از طرفی یون سدیم (+Na) برای خنثی شدن نیاز دارد الکترون بگیرد تا به سدیم مذاب (Na(s)) تبدیل شود، پس نیم واکنش کاتدی به صورت زیر خواهد بود:
Na+(aq)+e→Na(l)
و همان طور که در نیم واکنش کاتدی مشاهده میشود، سدیم مذاب تولید شده و با سرد شدن به فلز سدیم تبدیل خواهد شد.
میدانیم نقطه ذوب ترکیبهای یونی بالا است، مثلا سدیم کلرید در دمای 801 درجه سلسیوس، مذاب میشود، ولی برای پایین آوردن این دمای ذوب، میتوان از ترکیبهای یونی مناسبی مانند کلسیم کلرید (CaCl2) یا منیزیم کلرید (MgCl2) استفاده کرد، که با استفاده از CaCl2 دمای انجام فرایند تا 587 درجه سلسیوس کاهش مییابد و از نظر کاهش انرژی لازم برای ذوب کردن ترکیب، صرفه اقتصادی دارد.
هدف برقکافت سدیم کلرید، تهیه فلز سدیم بوده که این برقکافت نیز به سلول دانز مشهور است.
یک نظر
نیم واکنش آندی:
Cl2+2e _____2cl
نیم واکنش کاتدی:
Mg——2e++Mg2