همان طور که در پست سلولهای الکتروشیمی آموختیم، سلولهای الکترولیتی دارای باتری بوده و فقط یک محلول الکترولیت دارند (برخلاف سلولهای گالوانی که دو محلول الکترولیت متفاوت داشتند) و در سلول الکترولیتی، دیگر خبری از پل نمکی یا دیوار متخلخل نیست، مطابق شکل زیر:
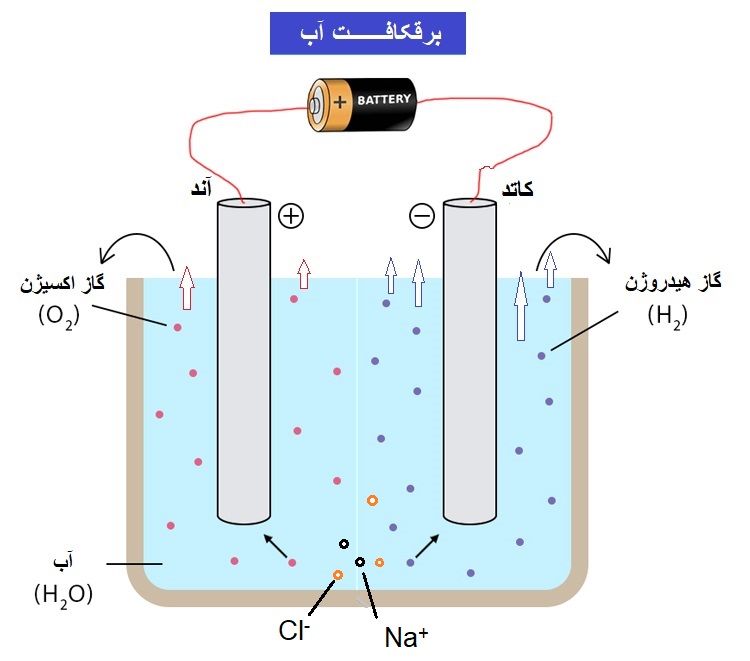
در سلولهای الکترولیتی، مانند سلولهای گالوانی جریان در سیم، از آند به کاتد برقرار است؛ ولی از آنجایی که قطب مثبت باتری به آند متصل بوده و قطب منفی باتری به کاتد متصل است، برخلاف سلولهای گالوانی، در سلولهای الکترولیتی، آند قطب مثبت و کاتد قطب منفی محسوب میشوند.
حال به سراغ نیم واکنش آندی و کاتدی برقکافت آب میرویم:
از آنجایی که در آند، اکسایش یا از دست دادن الکترون رخ میدهد، پس آب در بخش آندی، مطابق واکنش زیر الکترون از دست میدهد و نیم واکنش آندی آب چنین خواهد بود:
2H2O(l)→O2(g)+4H+(aq)+4e–
از طرفی در کاتد، کاهش یا گرفتن الکترون انجام میشود، پس آب در بخش کاتدی، مطابق واکنش زیر الکترون میگیرد و نیم واکنش کاتدی آب به صورت زیر خواهد بود:
2H2O(l)+2e–→H2(g)+2OH–(aq)
در نتیجه با توجه به موازنۀ بار نیم واکنشها، واکنش کلی برقکافت آب به صورت زیر میباشد:
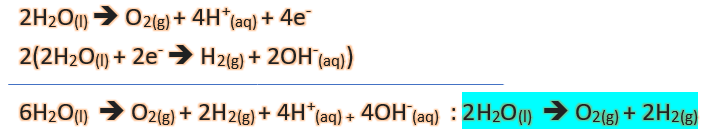
یکی کاربردهای مهم برقکافت آب، تهیه گاز ارزشمند هیدروژن (H2) میباشد.