با هم بیندیشیم صفحه5 شیمی دوازدهم
چربیها را میتوان مخلوطی از اسیدهای چرب و استرهای بلند زنجیر (با جرم مولی زیاد) دانست. با توجه به شکلهای زیر به پرسشها پاسخ دهید.
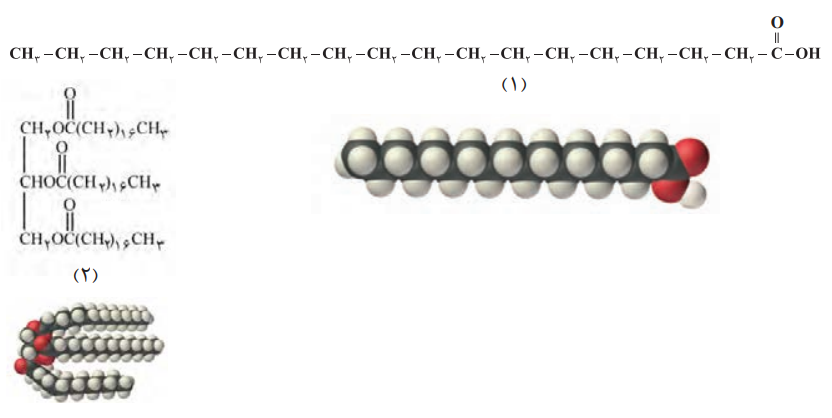
آ) کدامیک فرمول ساختاری یک اسید چرب و کدامیک فرمول ساختاری یک استر با جرم مولی زیاد را نشان میدهد؟ چرا؟
پاسخ:
ساختار (1) اسید چرب است، زیرا اسید چرب همان کربوکسیلیک اسیدی هست که دارای زنجیر بلند کربنی باشد، از طرفی کربوکسیلیک اسیدها دارای گروه عاملی کربوکسیل (COOH-) هستند، که این گروه عاملی را در ساختار (1) مشاهده میکنیم.
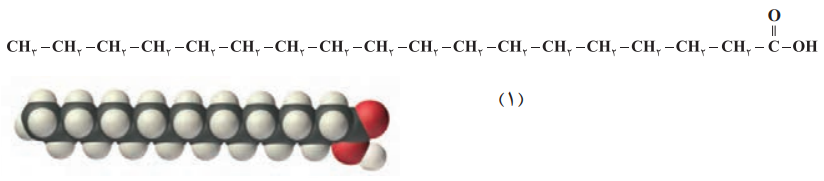
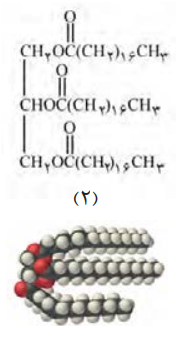
ساختار (2) نیز استر بوده زیرا دارای فرمول R1COOR2 میباشد، و از ترکیب کربوکسیلیک اسید (از نوع اسید چرب) و الکل (گلیسیرول) به دست میآید.
ب) بخشهای قطبی و ناقطبی هر مولکول را مشخص کنید.
پاسخ:
در مورد اسید چرب (ساختار 1) گروه کربوکسیل بخش قطبی بوده و قسمت هیدروکربنی، بخش ناقطبی میباشد:
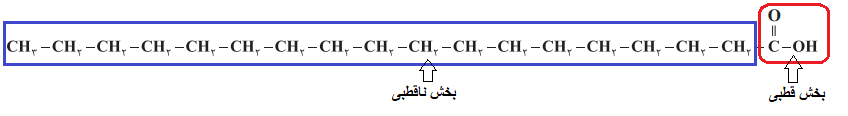
در مورد استر نیز بخش هیدروکربنی ناقطبی بوده و بخش COO قطبی محسوب میشود:
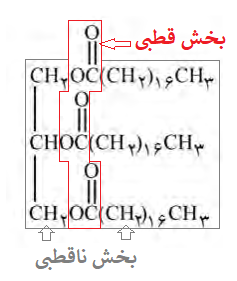
ب) دانشآموزی الگوی زیر را برای نمایش یک مولکول اسیدچرب و یک استر سنگین ارائه کرده است. در هر یک از این مولکولها، بخش قطبی و بخش ناقطبی را مشخص کنید.
پاسخ:
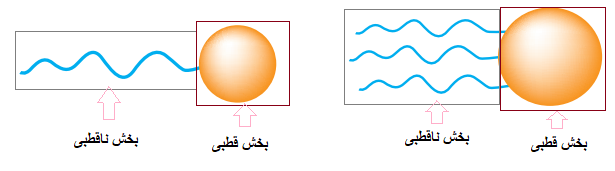
قسمت دم در شکلهای بالا (بخش ناقطبی) همان هیدروکربن موجود در ساختار اسید چرب و استر میباشد، و قسمت دایرهای در شکلهای بالا (بخش قطبی) همان گروه عاملی کربوکسیل در اسید چرب یا گروه عاملی استر در چربی (استر) است.
ت) نیروی بینمولکولی غالب در چربیها از چه نوعی است؟ چرا؟
پاسخ:
نیروی بین مولکولی غالب در چربیها از نوع واندروالس میباشد؛ زیرا نیروی بین مولکولی در ساختارهایی که اتم هیدروژن از یک مولکول به یکی از اتمهای فلوئور و نیتروژن و یا اکسیژن در مولکول دیگر متصل نمیشود، از نوع نیروی بین مولکولی واندروالس است. برای درک بهتر نیروهای بین مولکولی این پست را مطالعه فرمایید.
ث) چرا چربیها در آب حل نمیشوند؟ توضیح دهید.
پاسخ:
چربیها مولکولهای غیرقطبی هستند، در حالی که آب یک حلال قطبی است. بر اساس قاعده “شبیه، شبیه را حل میکند”، این دو نمیتوانند با هم برهمکنش مؤثری داشته باشند. بنابراین، چربیها ترجیح میدهند به جای حل شدن در آب، در کنار هم جمع شوند و جدا بمانند.
2- صابون را میتوان نمک سدیماسید چرب دانست. فرمول همگانی این نوع صابونها که جامد هستند، R–COONa بوده که در آن R یک زنجیر هیدروکربنی بلند است. ساختار زیر نوعی صابون را نشان میدهد. با توجه به آن به پرسشها پاسخ دهید.
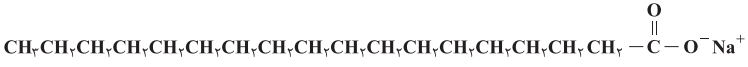
آ) بخشهای قطبی و ناقطبی آن را مشخص کنید.
پاسخ:
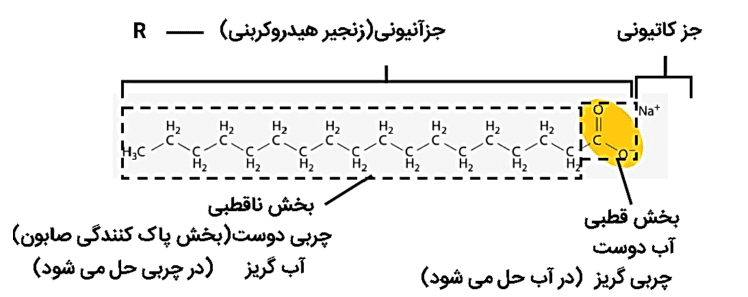
ب) کدام بخش صابون آبدوست و کدام بخش آبگریز است؟
پاسخ:
در شکل بالا بخش آبدوست و بخش آبگریز مشخص شده است، دلیل آن نیز این است که بخش قطبی صابون با یک حلال قطبی (مانند آب) محلول شده و بخش ناقطبی صابون در آب محلول نبوده و اصطلاحا آبگریز میباشد و با مواد ناقطبی (مانند چربی) تشکیل محلول میدهد.
پ) هرگاه مخلوط مقداری از این صابون و آب را هم بزنید، مولکولهای صابون در سرتاسر مخلوط پخش میشوند. از این تجربه درباره نیروهای جاذبه بین صابون و آب چه نتیجهای میگیرید؟ توضیح دهید.
پاسخ:
یون سدیم موجود در صابون (+Na) نیروی بین مولکولی یونی-دوقطبی با آب برقرار میکند و سمت ناقطبی صابون، که بخش آب گریز بوده به دلیل حضور زنجیره هیدروکربنی، ناقطبی هست در مواد ناقطبی مانند چربی و آلایندهها حل میشود و نیروی بین مولکولی واندروالس بین آنها شکل میگیرد.
ت) هرگاه مقداری صابون مایع را در روغن بریزید و مخلوط را به هم بزنید، مخلوطی مانند شکل پایین به دست میآید. با توجه به این مشاهده، درباره درستی جمله زیر گفتوگو کنید.
“صابون مادهای است که هم در آب و هم در چربی حل میشود.”

پاسخ:
- ساختار دوگانه صابون: مولکول صابون یک سر آبدوست (قطبی) و یک دم چربیدوست (غیرقطبی) دارد.
- رفتار در روغن (چربی): وقتی صابون را در روغن هم میزنید، دمهای غیرقطبی مولکولهای صابون در محیط روغن (که آن هم غیرقطبی است) احساس راحتی میکنند. اما سرهای قطبی آنها تمایل دارند تا حد ممکن از محیط غیرقطبی روغن دور بمانند.
- تشکیل کلوئید و کدر شدن: در اثر همزدن، مولکولهای صابون خود را به صورت ساختارهایی سازماندهی میکنند که سرهای قطبی آنها در مرکز جمع شده و دمهای غیرقطبی به سمت بیرون (در تماس با روغن) قرار میگیرند، این ساختارها قطرات ریز آب (که ممکن است از خود صابون یا رطوبت محیط باشد) یا خود صابون را احاطه کرده و در روغن پراکنده میکنند. پراکندگی این قطرات ریز در روغن است که باعث کدر شدن مخلوط میشود. توجه داشته باشیم این مخلوط یک امولسیون (نوعی کلوئید) است، نه یک محلول.
برای درک بهتر خودآزمایی بالا، این پست را مطالعه فرمایید یا در این آزمون رایگان شرکت کنید.

