با هم بیندیشیم صفحه22 شیمی دوازدهم
جدول زیر غلظت تعادلی گونههای موجود در سه محلول از هیدروفلوئوریک اسید با غلظتهای آغازی گوناگون را در دمای 250C نشان میدهد. با توجه به آن به پرسشها پاسخ دهید.
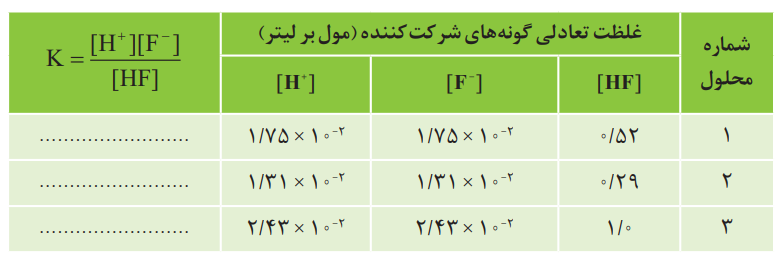
آ) توضیح دهید چرا در هر سه محلول [+H]=[−F] است؟
پاسخ:
زیرا در واکنش یونش: (aq)−HF(aq)⇌H+(aq) + F هر مولکول HF که یونیده میشود، طبق استوکیومتری، دقیقاً یک مولکول یون +H و یک مولکول یون −F تولید میکند. بنابراین، غلظت این دو یون در حالت تعادل با هم برابر است.
ب) کسر داده شده در ستون آخر را عبارت ثابت تعادل مینامند و با K نمایش میدهند. مقدار K را حساب کرده و جاهای خالی را پر کنید.
پاسخ:

2- اگر غلظت تعادلی یون هیدرونیوم در محلول استیک اسید در دمای معین برابر با 0.0006mol.L-1 باشد:
آ) غلظت تعادلی یون استات (−CH3COO) را تعیین کنید.
پاسخ:
واکنش یونش به صورت زیر میباشد:
(aq)−CH3COOH(aq)⇌H+(aq)+CH3COO
با توجه به برابر بودن ضرائب استوکیومتری یون استات و یون هیدرونیوم در واکنش یونش بالا، پس غلظت آنها با هم برابر خواهد بود:
[CH3COO−]=[H+]=0.0006mol.L-1
ب) اگر غلظت تعادلی استیک اسید در این محلول برابر با 0.02 مولار باشد، ثابت تعادل را در این دما حساب کنید.
پاسخ:
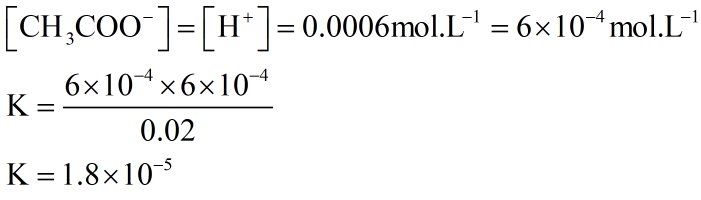
برای درک بهتر خودآزمایی بالا، این پست را مطالعه فرمایید یا در این آزمون رایگان شرکت کنید.

