
در فرمول بالا، مقدار عملی همان مقداری از یک فراورده است که در آزمایشگاه به دست میآید و مقدار نظری آن مقداریست که ما با استفاده از استوکیومتری به دست میآوریم.
دلیل اینکه در بازده درصدی، از نام فراوردهها استفاده شد، این است که، بازده به انتهای یک فرایند اختصاص دارد و در یک واکنش، انتها یعنی محصول یا فراورده.
همیشه مقدار عملی از مقدار نظری کمتر است، زیرا یک میزان از اتلاف انرژی و ناخالصیها را به طور دقیق نمیتوان در نظر گرفت، پس بازده درصدی نمیتواند 100% باشد.
حال برای درک بهتر دو مثال از کتاب شیمیوم حل کنیم که به صورت تعاملی میان مدرس و شاگرد (به نام هوشمند) است:
مثال1: طی واکنش زیر، در صورتی که 33 گرم فلز آهن از مصرف 33 گرم کربن مونوکسید تولید شود، بازده درصدی آهن را محاسبه کنید. Fe:56g/mol , CO:28g/mol
Fe2O3(s)+CO(g)→Fe(s)+CO2(g)
در ابتدا واکنش را موازنه میکنیم و از آنجایی که اکسیژن بیشتر از بقیه اتمها تکرار شده است، اکسیژن را در آخر موازنه میکنیم، پس اول به Fe در سمت فرآوردهها 2 میدهیم و در ادامه به CO سمت واکنش دهنده 3 میدهیم و به CO2 در سمت فراورده هم 3 میدهیم که معادله موازنه شده، به صورت زیر درمیآید:
Fe2O3(s)+3CO(g)→2Fe(s)+3CO2(g)
حال با استفاده از مقدار داده شدۀ کربنمونوکسید، مقدار تولیدی فلز آهن را با استوکیومتری به دست میآوریم: بدین صورت که با استفاده از جرم مولی کربن مونوکسید، به مول آن رسیده و با استفاده از کسر نسبت مولی، به مول آهن میرسیم و از طریق جرم مولی آهن، به جرم آهن میرسیم:

پس مقدار آهن تولید شده برابر با ۴۴ گرم است، اما در صورت سوال گفته شده که مقدار ۳۳ گرم آهن از این واکنش به دست میآید و همانطور که گفتیم در بازده درصدی، آن مقداری را که ما با استفاده از استوکیومتری به دست میاریم همان مقدار نظری است و مقداری که صورت سوال به ما داده، در اصل همان مقداری است که در واقعیت تولید شده و مقدار عملی است، پس با تقسیم مقدار عملی بر مقدار نظری، مقدار بازده درصدی به دست میآید که برابر خواهد بود با ۷۵ درصد:

حالا یه سوال بدم آقا هوشمند شما جواب بدین؟
هوشمند: بله بفرمایید
سوال: از واکنش 0.3 مول باریم کلرید با درصد خلوص 80% طی واکنش زیر، چند گرم باریم سولفات با بازده درصدی 90% تولید میشود؟ BaSO4:233g/mol
3BaCl2(aq)+Al2(SO4)3(aq)→3BaSO4(s)+2AlCl3(aq)
هوشمند: آقا باز نوبت من شد هرچی درس داده بودین تا الان، کردین تو یه سوال؟
مدرس: میخوای تا خودم حلش کنم ؟
هوشمند: نه الان بهتون نشون میدم چقدر خوب درس رو یاد گرفتم.
اول چون درصد خلوص داده، باید مقدار خالص واکنش دهنده را به دست بیاریم تا با استفاده از اون، باریم سولفات که فرآورده هست رو به دست بیارم؛ پس 0.3 مول رو ضربدر 80 درصد خلوص که کنم میشه: 0.24 مول (0.24=0.8×0.3) که تعداد مول خالص باریم کلرید هس، حالا با استفاده از استوکیومتری مقدار گرم باریم سولفات رو به دست میاریم، به این صورت که از مول باریم کلرید با کسر نسبت مولی به مول باریم سولفات میرسیم و با جرم مولیِ باریم سولفات، به جرمش میرسیم:
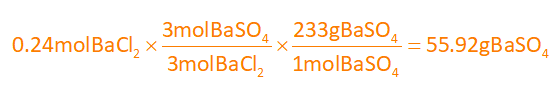
بازده درصدی هم که بهمون داده 90% ما هم مقدار نظری رو از تو استوکیومتری دست آوردیم (چون گفتین استوکیومتری مقدار نظری رو به ما میده) فقط میمونه مقدار عملی، که از ضرب بازده درصدی در مقدار نظری، مقدار عملی باریم سولفات هم به دست میاد:
