مثلا اتانول یک ماده مولکولی با فرمول C2H5OH است که با توجه به ساختار آن، قطبیت بالایی داشته و از آنجایی که نیروی بین مولکولی آن هیدروژنی است (چون اتم هیدروژن از یک مولکول آن به اتم اکسیژن در مولکول دیگر آن متصل میشود) به خوبی در آب حل میشود. همچنین با توجه به اینکه آب نیز یک مادۀ مولکولی با فرمول H2O محسوب میشود، پس انحلال اتانول در آب، انحلال مولکولی هست.
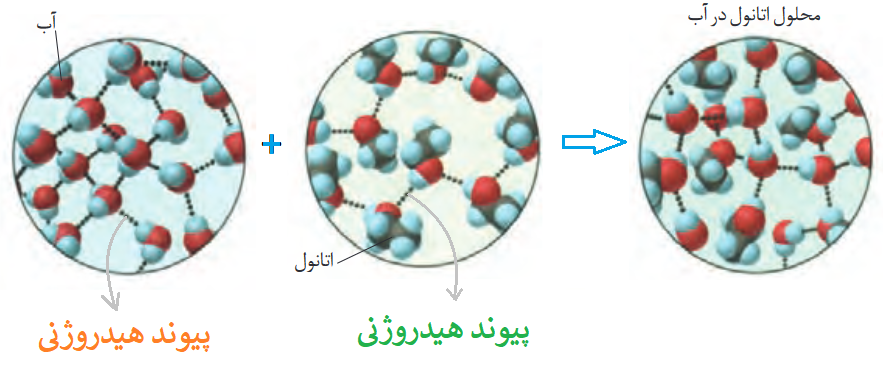
در انحلال مولکولی نیروهای بین مولکولی حلال (مانند آب) و نیروی بین مولکولی حل شونده (مانند اتانول) از بین رفته و نیروی بین مولکولی جدیدی بین حلال و حل شونده به وجود میآید.
نیروی بین مولکولی جدید میان حلال و حل شونده (مانند آب و اتانول) از میانگین نیروهای بین مولکولی اولیه (مثلا نیروی بین مولکولی آب و نیروی بین مولکولی اتانول) بیشتر است.
فراموش نکنیم در انحلال مولکولی، مواد قطبی تمایل دارند در مواد قطبی حل شده و مواد ناقطبی در مواد ناقطبی تمایل به حل شدن دارند.

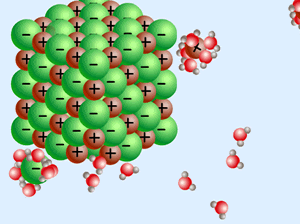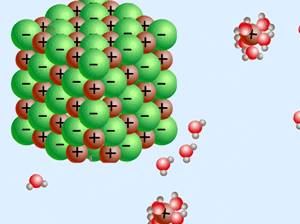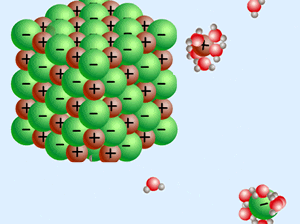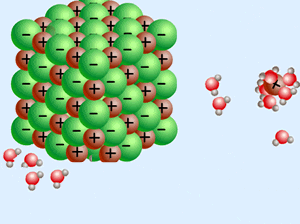
زمانی که یک ترکیب یونی (مانند NaCl) درون آب (که یک مولکول قطبی است) حل میشود، انحلال یونی رخ داده است.
در این نوع انحلال، نیروی بین مولکولی آب از بین رفته و نیروی بین اتمی یونها نیز از بین میرود و مولکولهای آب، یونها را احاطه میکنند که به این پدیده آبپوشی گفته میشود و نیروی به وجود آمده میان آب و یونها را یون-دوقطبی گوییم.