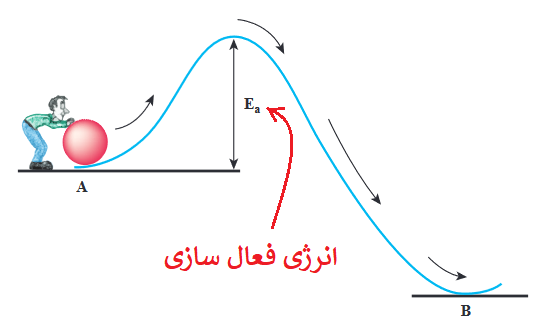
با توجه به شکل بالا، هر چقدر انرژی فعال سازی بیشتر باشد، رسیدن به قلۀ آن (بالاترین سطح انرژی آن) دیرتر و انجام آن واکنش سختتر است.
انرژی فعال سازی را با Ea نشان میدهیم.
با توجه به تعریف انرژی فعال سازی، اگر در یک واکنش، انرژی که به واکنش دهندهها برای تبدیل به فراوردهها داده میشود کمتر از انرژی فعال سازی باشد، آن واکنش انجام نمیشود و واکنش دهندهای تبدیل به فراورده نمیشود، پس نتیجه میگیریم انرژی فعال سازی (Ea) حداقل انرژی لازم برای انجام یک واکنش است.
قبل از اینکه به سراغ انرژی فعال سازی در واکنشهای گرماگیر و گرماده برویم بهتر است مروری داشته باشیم بر واکنشهای گرماگیر و گرماده و بحث آنتالپی واکنش، از شیمی 2:
وقتی گرما از محیط به سامانه منتقل میشود سطح انرژی یا آنتالپی واکنش افزایش مییابد؛ و
زمانی که گرما از سامانه به محیط منتقل میشود سطح انرژی یا آنتالپی واکنش افزایش مییابد.
حال به آن دسته از واکنشها که گرما از محیط به سامانه منتقل شده، گرماگیر گوییم؛ و
آن دسته از واکنشها که گرما از سامانه به محیط منتقل میشوند را، گرماده گوییم.
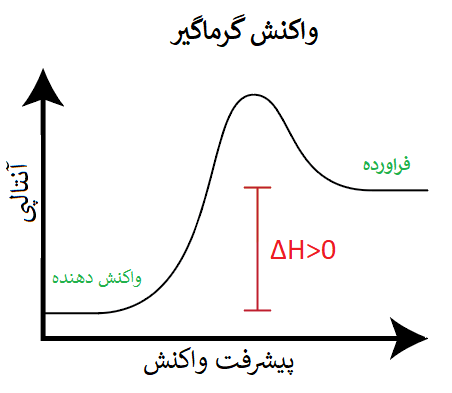
پس میتوان گفت در واکنشهای گرماگیر، سطح انرژی فراوردهها از واکنش دهندهها بیشتر است، چون گرما از محیط به سامانه منتقل شده، و سامانه با دریافت گرما، سطح انرژی پایانی آن (یعنی فراوردهها) از سطح انرژی ابتدایی آن (یعنی واکنش دهنده) بیشتر خواهد شد.
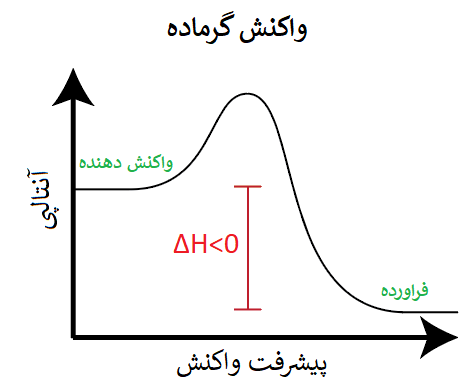
همچنین میتوان گفت در واکنشهای گرماده، سطح انرژی واکنش دهندهها از فراوردهها بیشتر است، چون گرما از سامانه به محیط منتقل شده، و سامانه با از دست دادن گرما، سطح انرژی پایانی آن (یعنی فراوردهها) از سطح انرژی ابتدایی آن (یعنی واکنش دهنده) کمتر خواهد شد.
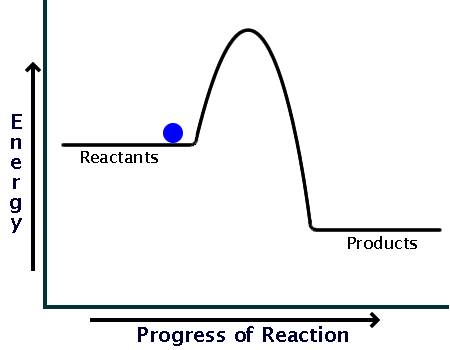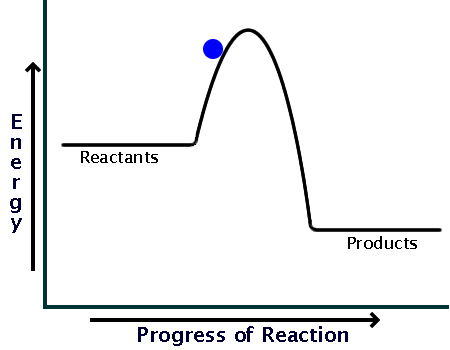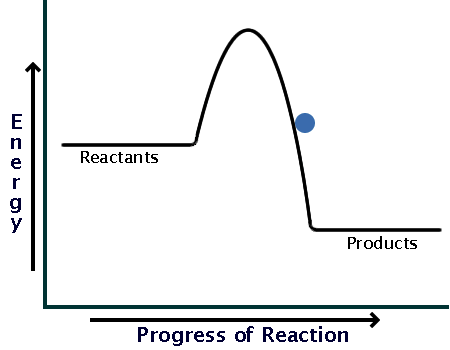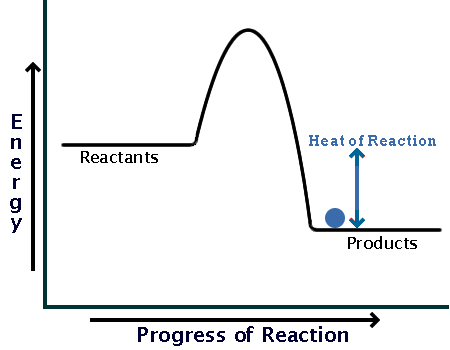
از طرفی آنتالپی واکنش، برابر با اختلاف آنتالپی یا سطح انرژی فراوردهها فراوردهها و واکنش دهندهها است، یا:
ΔH=H2-H1
که در رابطۀ بالا ΔH همان آنتالپی واکنش بوده و H2 آنتالپی یا سطح انرژی فراوردهها میباشد و H1 آنتالپی یا سطح انرژی واکنش دهندهها محسوب میشود.
اکنون با استفاده از ΔH برای واکنشهای گرماگیر و گرماده، میتوان نتیجه گرفت که:
یک نظر
دیرتر،زیرا سطح انرژی کمتر بوده و تا بخواهد به قله برسد انرژی بیشتر باید مصرف شود