به عبارتی با افزایش فشار، انحلالپذیری گازها در آب زیاد شده و با افزایش دما، انحلالپذیری گازها کاهش مییابد.
به افزایش انحلالپذیری گازها در آب، با افزایش فشار، قانون هنری گویند.
با توجه به قانون هنری در جدول زیر:
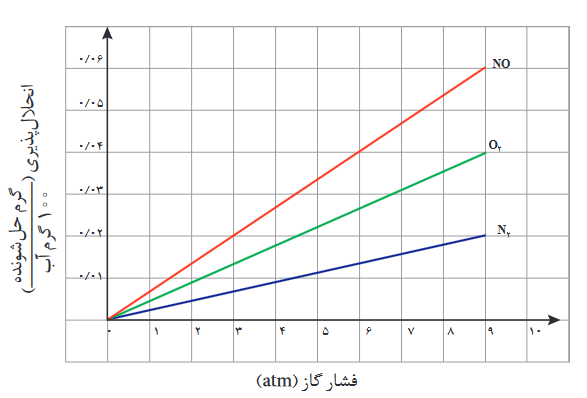
همان طور که مشاهده میکنیم، انحلالپذیری گازها در آب با افزایش فشار، بیشتر میشود.
اما میبینیم که انحلالپذیری گاز NO از گازهای N2 و O2 بیشتر است، دلیل: گاز NO برخلاف گازهای N2 و O2 قطبی است و گشتاور دوقطبی آن مثبت است، پس انحلالپذیری بیشتری در آب دارد، زیرا آب نیز قطبی است.
ولی اگر گاز CO2 را در آب وارد کنیم، با وجود اینکه گشتاور دوقطبی آن صفر است (ناقطبی است) حلالیت بیشتری نسبت به گاز NO در یک فشار برابر دارد. و دلیل آن جرم مولی بیشتر گاز CO2 نسبت به گاز NO هست.
گازها با وجود اینکه با افزایش فشار، حلالیت آنها در آب بیشتر میشود، اما باز هم به خوبی در آب حل نمیشوند. مثلا در فشار 1 اتمسفر و دمای اتاق گازهای نمودار بالا نامحلول در آب محسوب میشوند (زیرا کمتر از 0.01g از آنها در 100g آب حل میشوند)
طبق نمودار زیر، همان طور که گفته شد حلالیت گازها در آب با افزایش دما، کاهش مییابد:
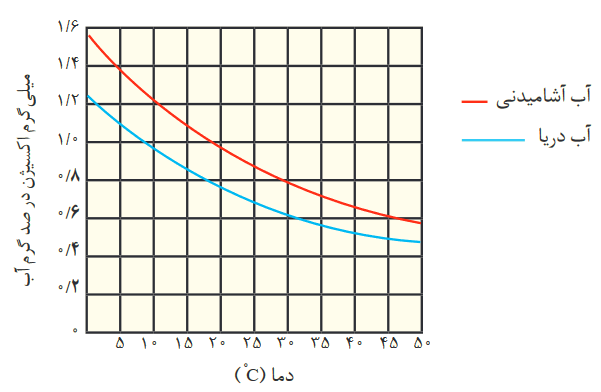
دلیل اینکه انحلال گاز اکسیژن در آب دریا کمتر از آب آشامیدنی هست، این است که: آب دریا حاوی املاح و یونها هست که باعث میشود تمایل آب دریا به انحلالپذیری با گازها کاهش یابد.