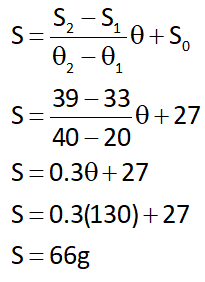همان طور که در مطلب قبلی متوجه شدیم انحلال نمکها در آب از نوع انحلال یونی به شمار میرود و نیروی جاذبۀ آنها از نوع یونی دوقطبی محسوب میشود.
البته دستهای از نمکها در آب حل نمیشوند مانند: AgCl یا BaSO4
حال طبق نمودار زیر:

همان طور که مشاهده میکنیم انحلالپذیری تمامی نمکها (به جز Li2SO4) با افزایش دما در آب افزایش مییابد. مثلا انحلالپذیری KCl در 60 درجه سانتیگراد برابر با 45g در 100g آب است، ولی در 75 درجه سانتیگراد، 50g از آن را میتوان در 100g آب حل کرد.
اگر 45g از نمک KCl را در دمای 75 درجه سانتیگراد حل کنیم، محلولی سیرنشده خواهیم داشت، زیرا همان طور که گفته شد در 75 درجه سانتیگراد، 50g از KCl در 100g آب باید حل شود تا محلولی سیرشده داشته باشیم.
متقابلا اگر در این دما، 55g از KCl را در آب حل کنیم، 5g از آن رسوب میکند، زیرا باز هم همان طور که گفته شد در 75 درجه سانتیگراد، نهایتا 50g از KCl در 100g آب میشود، پس مقدار اضافی تهنشین کرده یا رسوب میکند.
آن دسته از نمکها که انحلالپذیری آنها در آب خطی است (مانند KCl یا NaCl یا Li2SO4 یا NaNO3) میتوان با استفاده از معادلۀ خط، معادلۀ انحلال پذیری آنها را به صورت زیر نوشت:

که در این فرمول:
S: میزان انحلالپذیری در دمای خواسته شده
S2: میزان انحلالپذیری در دمای 2θ
S1: میزان انحلالپذیری در دمای 1θ
S0: میزان انحلالپذیری در دمای 0 درجه سانتیگراد
مثال: با توجه به جدول زیر پیشبینی کنید در دمای 130 درجه سانتیگراد، انحلالپذیری KCl در 100g آب، چقدر خواهد بود؟

پاسخ: