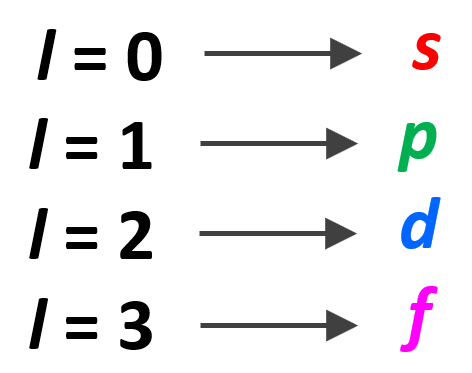اعداد کوانتومی به انرژی و محدودۀ مکانی الکترونهایی که در اطراف هسته، در مدارهای مشخصی میچرخند، اشاره میکنند.
اعداد کوانتومی در حد شیمی دهم و کنکور، شامل عدد کوانتومی اصلی (n) و عدد کوانتومی فرعی (l) میشوند.
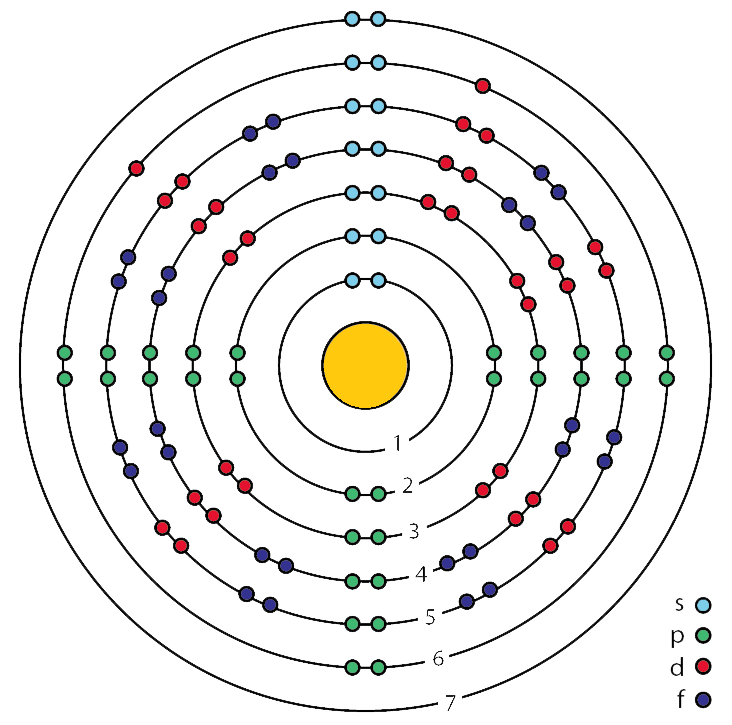
نشان دهندۀ لایه یا تراز انرژی است، چون هرچه لایه بیشتر باشد (از هسته دورتر باشد) انرژی بیشتر میشود.
عدد کوانتومی اصلی از 1 تا 7 را شامل میشود، یعنی 7 تا لایه یا تراز انرژی داریم.
نشان دهنده نوع زیرلایه است که شامل زیرلایههای s,p,d,f میشود.
عدد کوانتومی فرعی از صفر شروع میشود و تا n-1 ادامه دارد و:
اگر l=0 باشد، زیرلایه از نوع s هست، که نهایتا 2 الکترون در آن جای میگیرد.
اگر l=1 باشد، زیرلایه از نوع p هست، که نهایتا 6 الکترون در آن جای میگیرد.
اگر l=2 باشد، زیرلایه از نوع d هست، که نهایتا 10 الکترون در آن جای میگیرد.
اگر l=3 باشد، زیرلایه از نوع f هست، که نهایتا 14 الکترون در آن جای میگیرد.
زیرلایهها هم مانند لایهها، با تغییر نوع زیرلایه، انرژی آنها تغییر میکند؛ مثلا انرژی زیرلایۀ p از زیرلایۀ s بیشتر است (چون زیرلایۀ p توانایی داشتن الکترون بیشتری را نسبت به زیرلایۀ s دارد)