اصل لوشاتلیه
طبق اصل لوشاتلیه، هرگاه تغییری در یک واکنش تعادلی ایجاد شود، فرایند در جهتی تغییر می کند که تا جای ممکن تغییر انجام شده را جبران کند.
در پستهای قبل وقتی واکنشی به سمت فراورده پیش رود اصطلاحا می گوییم واکنش در جهت رفت انجام شده و برعکس، وقتی واکنشی به سمت واکنش دهنده ها پیش رود، می گوییم واکنش در جهت برگشت انجام شده است.
همچنین خواندیم: تنها عاملی که باعث تغییر مقدار ثابت تعادل (K) میشود، دما است؛ پس غلظت، فشار و حجم، مقدار ثابت تعادل را تغییر نمیدهند و فقط باعث میشوند تعادل جدیدی برقرار شود.
اکنون میخواهیم با استفاده از اصل لوشاتلیه، موضوع بالا را بررسی کنیم:
ابتدا از تغییرات غلظت شروع میکنیم:
اگر در واکنشی مقدار غلظت یکی از واکنش دهندهها را افزایش دهیم، طبق اصل لوشاتلیه واکنش برای جبران افزایش غلظت واکنش دهنده، در جهت رفت (به سمت فراورده ها) حرکت میکند که تا جای ممکن غلظت افزوده شده را مصرف یا کم کند، پس بدین صورت هم مقداری از غلظت واکنش دهندۀ افزوده شده، مصرف شده، و هم چون واکنش در جهت رفت حرکت میکند فراوردههای بیشتری تولید میشود و بدین ترتیب ثابت تعادل تغییری نمیکند.
برای درک بهتر به مثال زیر توجه فرمایید:
مثال: در یک ظرف سربسته، با افزایش غلظت ماده B ، پیشرفت واکنش در چه جهتی انجام میشود؟
A(g) + B(g) ⇌ C(g)
طبق اصل لوشاتلیه، با افزایش غلظت ماده B ، واکنش در جهتی پیش میرود که تا جای ممکن از مقدار اضافه شده مادۀ B کم کند، پس واکنش در جهت رفت (به سمت فروارده ها) پیش می رود تا ماده B مصرف شود، و تعادل جدیدی برقرار میشود؛ ولی همان طور که گفته شد با تغییرات غلظت انجام شده، مقدار ثابت تعادل تغییری نمیکند.
اکنون به سراغ یک مثال عددی برویم تا ثابت کنیم با تغییرات غلظت، مقدار عددی ثابت تعادل تغییر نمیکند:
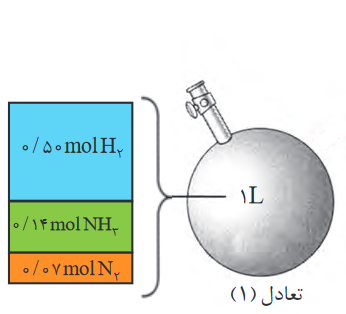
مثال 2: در واکنش تعادلی زیر غلظت گازهای هیدروژن، نیتروژن و آمونیاک با توجه به شکل، به ترتیب برابر: 0.5، 0.07 و 0.14 مول بر لیتر می باشند. در نتیجه ثابت تعادل با توجه به اعداد داده شده برابر خواهد بود با:
N2(g)+3H2(g)⇌2NH3(g)
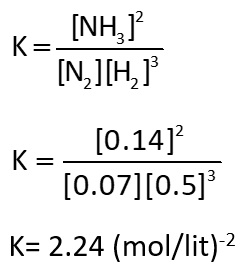
حال می خواهیم ببینیم اگر 0.05 مول گاز نیتروژن (N2(g)) به واکنش بالا اضافه کنیم، مقدار عددی ثابت تعادل پس از برقرار شدن تعادل جدید، با توجه به شکل زیر، تغییری خواهد کرد یا خیر؟
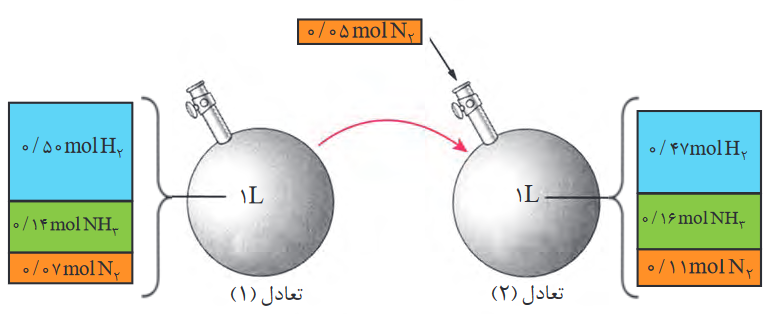
موردی که می دانیم این است که با افزودن گاز نیتروژن طبق اصل لوشاتلیه واکنش در جهتی جابه جا میشود که تا جای ممکن مقدار اضافه شده را مصرف کند و از آنجایی که گاز نیتروژن در سمت واکنش دهنده ها قرار دارد؛ واکنش از آن دور می شود و به سمت فراورده ها می رود که تا جای ممکن مقدار افزوده شده گاز نیتروژن را مصرف کند؛ یعنی: گاز نیتروژن باید اندکی از 0.12 مول کمتر شود (زیرا 0.07 مول از قبل داشتیم و 0.05 مول به آن اضافه شده که می شود 0.12 مول و بخاطر جابه جایی واکنش به سمت فراورده ها مقداری از این 0.12 مول کم می شود) از طرفی گاز هیدروژن نیز باید اندکی کمتر از 0.5 مول شود (چون همان طور که گفتیم واکنش به سمت فراورده ها می رود، پس اندکی از آن مصرف می شود) و متقابلا اندکی به غلظت گاز آمونیاک افزوده خواهد شد (به دلیل جابه جایی واکنش به سمت فراورده، چون مشاهده می کنیم که گاز آمونیاک فراورده است). غلظتهای به دست آمده طی افزوده شدن 0.05 مول گاز نیتروژن طبق شکل بالا ؛ در تعادل جدید برابرند با:
N2 = 0.11 mol, H2 = 0.47 mol, NH3 = 0.16 mol
جالب است که ثابت تعادل را که با اعداد جدید حساب کنیم، میبینیم واقعا ثابت تعادل فرقی نکرده است:
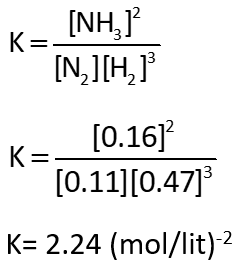
پس ثابت شد با تغییر غلظت، مقدار ثابت تعادل تغییری نمیکند.
حال به سراغ تغییرات فشار و حجم برویم:
منتها در ابتدا باید دو مورد را در نظر بگیریم:
- اول اینکه فشار و حجم همیشه وابسته به هم و برعکس همدیگر هستند، یعنی اگر بگوییم حجم یه سامانه زیاد شده مانند این است که بگوییم فشار سامانه کم شده است.
- مورد بعدی اینکه تغییرات فشار و حجم، بر روی سامانههایی که تعداد مول های گازی در سمت واکنش دهنده ها و فراورده ها برابر هست، تأثیری ندارد.
مثلا اگر در واکنشی ۳ مول گازی سمت واکنش دهنده ها و ۳ مول گازی سمت فراورده ها داشته باشیم (mol(g)=0∆)، کم و زیاد کردن فشار یا حجم جهت پیشرفت واکنش رو تغییر نمیدهد.
برای فهم بهتر تاثیر فشار و حجم بر یک واکنش تعادلی به سراغ یک مثال برویم:
مثال: در واکنش زیر افزایش حجم باعث پیشرفت واکنش در چه جهتی می شود؟
2A(g) + B(g) ⇌ C(g)
از آنجایی که افزایش حجم معادل کاهش فشار میباشد، پس طبق اصل لوشاتلیه، با کاهش فشار، واکنش برای جبران به سمتی میرود که تعداد مول های گازی بیشتر باشد، زیرا هرجا تعداد مول های گازی بیشتر باشد فشار نیز بیشتر است، در نتیجه با کاهش فشار، واکنش به سمت واکنش دهندهها می رود، چون واکنش دهندهها مجموعا ۳ مول گازی دارند (2 مول A و 1 مول B) و فراورده فقط ۱ مول گازی دارد. پس واکنش در جهت برگشت (واکنش دهنده ها) انجام میشود.
همان طور که گفته شد، تنها عاملی که میتواند ثابت تعادل را تغییر دهند دما هست. چون ما با تغییر دادن غلظت و فشار و حجم میبینیم واکنش در جهتی حرکت میکند که تعادلی جدید، ولی با مقدار عددی ثابت تعادل قبلی به وجود بیاورد در اصل واکنش با تغییراتش نمیگذارد مقدار ثابت تعادل عوض شود.
اکنون میخواهیم تاثیرات دما بر ثابت تعادل را بررسی کنیم:
ولی به دلیل طولانی شدن این پست و ایجاد تنوع، این مبحث را با ادبیات محاورهای و از زبان مدرس و شاگرد خواهیم آموخت:
مدرس: طبق تعریف خودمون از اصل لوشاتلیه، هر چیزی تو یه واکنش زیاد بشه، فرایند ازش دور میشه؛ اگه کم هم بشه، واکنش به سمتش حرکت میکنه.
به عنوان مثال در یه واکنش گرماده (H<0∆) اگر دما را افزایش دهیم؛ از آنجایی که در واکنشهای گرماده، گرما (Q) سمت فراورده ها هست:
A(g)+B(g)⇌C(g)+Q
طبق اصل لوشاتلیه واکنش از Q میخواد دور بشه و به سمت واکنش دهنده جابه جا میشه.
پس با افزایش دما، (در واکنشای گرماده) واکنش از Q دور میشه و میره سمت واکنش دهندهها. که در این حالت غلطت واکنش دهندهها افزایش و غلظت فراوردهها کاهش پیدا میکنه که منجر به کم شدن مقدار ثابت تعادل میشه، چون میدونیم ثابت تعادل با غلظت فراوردهها رابطه مستقیم و با غلظت واکنش دهندهها رابطه عکس داره.
متقابلا در یک واکنش گرماگیر (فراوردهها⇌واکنش دهندهها+Q) با افزایش دما، واکنش تلاش به دور شدن از گرمای افزوده شده دارد و از آنجایی که در واکنشهای گرماگیر Q در سمت واکنش دهندهها قرار دارد، واکنش به سمت فراوردهها جابه جا میشود، در نتیجه از غلظت واکنش دهندهها کم شده و بر غلظت فراوردهها افزوده میشود، که منجر به افزایش مقدار ثابت تعادل خواهد شد.
مدرس خطاب به شاگرد: شما حالا میتونی به من بگی چرا در یه واکنش گرماده با کاهش دما، مقدار ثابت تعادل افزایش پیدا میکنه؟
شاگرد: اجازه چون در واکنش گرماده Q سمت فراورده هس، و با کاهش دما، واکنش برای جبران مقدار کم شده به سمتش حرکت میکنه (یعنی واکنش میره به سمت فراورده) پس غلظت فراوردهها زیاد میشه و غلظت واکنش دهندهها کم میشه، خب ثابت تعادل هم که نسبت غلظت فراوردهها به واکنش دهنده هس، پس مقدار ثابت تعادل هم زیاد میشه.
مدرس: آفرین، حالا با کاهش دما در یه واکنش گرماگیر چه اتفاقی برای ثابت تعادل میوفته؟
شاگرد: اجازه چون در واکنش گرماگیر Q سمت واکنش دهنده هس، و با کاهش دما، واکنش برای جبران مقدار کم شده به سمتش حرکت میکنه (یعنی واکنش میره به سمت واکنش دهنده) پس غلظت واکنش دهندهها زیاد میشه و غلظت فراوردهها کم میشه، ثابت تعادل هم که نسبت غلظت فراوردهها به واکنش دهنده هس، پس مقدار ثابت تعادل هم کم میشه.
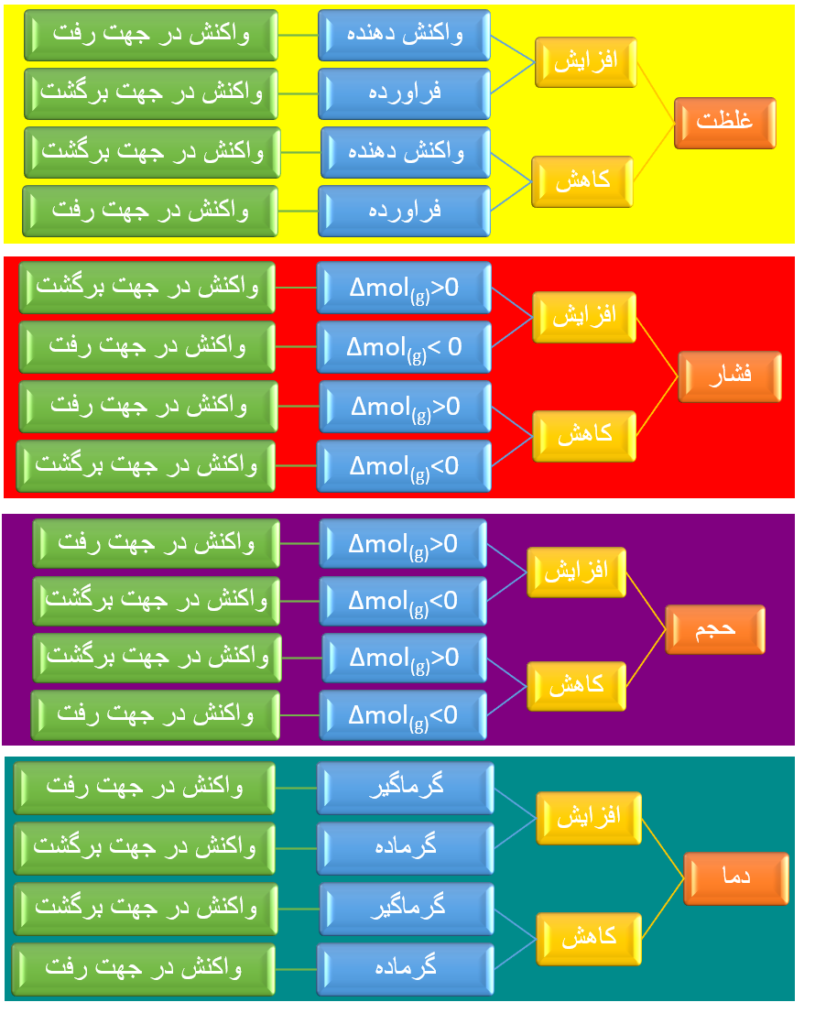
پس جمع بندی اصل لوشاتلیه به صورت زیر خواهد بود:


یک نظر
هر چه فشار کمتر شود غلظت بیشتر میشود زیرا واکنش میخواهد غلظت افزایش یافته را مصرف کند پس در جهت رفت حرکت میکند