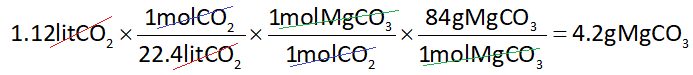به یاد داشته باشیم که ماده و واحد صورت هر کسر با ماده و واحد مخرج کسر بعدی باید یکی باشد تا با هم خط بخورند و ساده شوند.
مثال: با تجزیه چند گرم منیزیم کربنات 1120 میلیلیتر گاز دی اکسید کربن در شرایط STP آزاد میشود؟ Mg=24g/mol, C:12g/mol, O:16g/mol
MgCO3(s)→MgO(s)+CO2(g)
در ابتدا موازنه بودن واکنش را بررسی میکنیم که با توجه به برابر بودن تعداد اتمها در دو طرف متوجه میشویم که واکنش موازنه است.
حال استوکیومتری را انجام میدهیم:
با توجه به توضیحات ابتدای مطلب، با استفاده از حجم مولی استاندارد گازها (22.4lit/mol) از حجم گاز CO2 به مول آن میرسیم و با استفاده از کسر مولی، از مول CO2 به مول MgCO3 میرسیم و از طریق جرم مولی MgCO3 به جرم آن میرسیم:
پس در ابتدا نیاز به جرم مولی MgCO3 داریم: MgCO3:24+12+3(16)=84g/mol
از طرفی چون حجم گاز CO2 را بر اساس میلیلیتر داده آن را به لیتر تبدیل میکنیم: (چون واحد حجم در شرایط STP بر اساس لیتر است)
1120mlit=1.12lit
در نتیجه کسرهای استوکیومتری به صورت زیر خواهند بود:
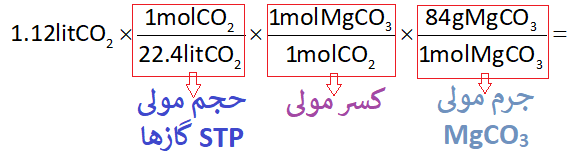
حال با ساده کردن کسرها به پاسخ نهایی میرسیم: