آنتالپی پیوند، مقدار انرژی لازم برای شکستن یک پیوند بین اتمی در حالت گازی میباشد.
دلیل اینکه از حالت گازی استفاده میکنیم این هست که با در نظر گرفتن حالت گازی یک ماده، دقت محاسبه را بالا میبریم؛ چون در حالت گازی میتوان از نیروی بین مولکولی صرف نظر کرد.
آنتالپی لازم برای شکستن نیروی بین اتمی، میان برخی از اتمها، به ازای 1 مول از آنها، در دو جدول زیر آورده شده است:
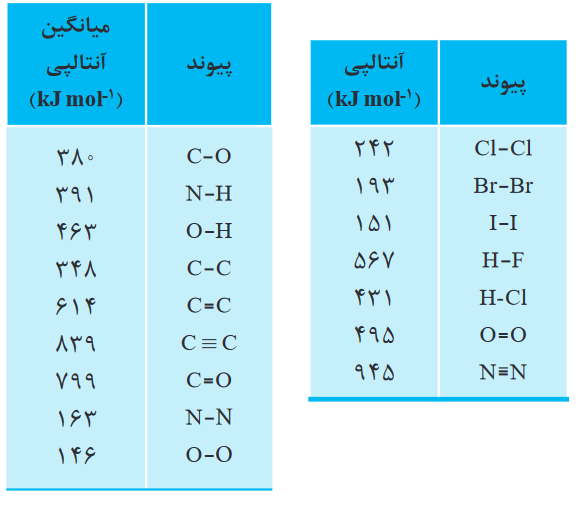
دلیل اینکه دو جدول بالا، یکی برحسب آنتالپی پیوند و دیگری برحسب آنتالپی پیوند میانگین آورده شده این است که:
زمانی که میخواهیم نیروی بین دو اتم در یک مولکول دو اتمی را بشکنیم از آنتالپی پیوند استفاده کرده و زمانی که میخواهیم نیروی بین دو اتم در یک مولکول دارای بیش از دو اتم را بشکنیم از آنتالپی پیوند میانگین استفاده میکنیم.
حالا بریم سراغ مثال:
مثال: آنتالپی واکنش زیر را با استفاده از آنتالپی پیوند به دست آورید:
(N≡N : 945kJ.mol-1 , H-H : 436kJ.mol-1 , N-H : 391kJ.mol-1)
پاسخ: آنتالپی واکنش برابر است با: تفاضل (مجموع آنتالپی پیوند، میان مواد واکنش دهندهها و مجموع آنتالپی پیوند، میان فراوردهها) در نتیجه از آنتالپی پیوند واکنش دهندهها شروع میکنیم: در ساختار گاز نیتروژن (N2) یک پیوند N≡N وجود دارد، و در ساختار گاز هیدروژن (H2) یک پیوند H-H وجود دارد که طبق ضریب استوکیومتری آن 3 تا مولکول H2 داریم، پس مجموع آنتالپی پیوند واکنش دهندهها برابر است با:
N≡N + 3(H-H) :
944 + 3(436) = 2253Kj
حال آنتالپی پیوند فراوردهها را به دست میآوریم: در ساختار آمونیاک (NH3) سه تا پیوند N-H داریم و دارای ضریب استوکیومتری 2 هست، پس مجموع آنتالپی پیوند فراوردهها برابر است با:
2×3(N-H) :
6(391) = 2346Kj
پس تفاضل (مجموع آنتالپی پیوند، میان مواد واکنش دهندهها و مجموع آنتالپی پیوند، میان فراوردهها) که برابر با ΔH است، برابر است با:
ΔH=2253-2346= -93kJ