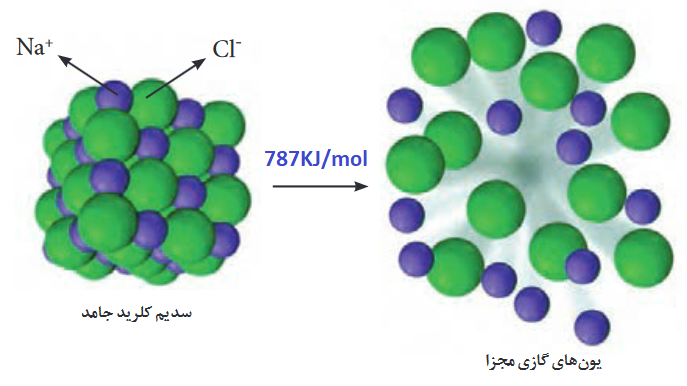
مطابق شکل بالا آنتالپی فروپاشی، برای تبدیل یک مول NaCl جامد به +Na گازی و –Cl گازی، برابر با ۷۸۷ کیلو ژول بر مول است:
NaCl(s)+787KJ/mol→Na+(g)+Cl–(g)
یکی از مهمترین کاربردهای انرژی فروپاشی این هست که بهترین ملاک برای مقایسه نقطه ذوب ترکیبهای یونی هست. به عبارتی هرچه انرژی فروپاشی یک ترکیب یونی بیشتر باشد آن ترکیب یونی، دارای نقطه ذوب بالاتری خواهد بود.
حال انرژی فروپاشی با چگالی بار یون، رابطه مستقیم دارد، پس هرچه چگالی بار کاتیون و آنیون یک ترکیب بیشتر باشد، انرژی فروپاشی آن ترکیب یونی بیشتر بوده و آن ترکیب دارای نقطۀ ذوب بالاتری میباشد.
منظور از چگالی بار، نسبت مقدار بار یک یون به شعاع یونی آن است، به عبارتی هرچه بار یک یون بیشتر باشد و شعاع یونی آن کمتر باشد، چگالی بار آن یون نیز بیشتر است.
برای درک بهتر چگالی بار و شعاع یونی به مثال زیر توجه کنید:
مثال: کدام ترکیب یونی دارای بیشترین نقطه ذوب میباشد؟
NaF, Na2O, KF, K2O
پاسخ: بیشترین نقطۀ ذوب مربوط به ترکیبی است که بیشترین چگالی بار را دارد، پس:
در این سوال ابتدا کاتیونها را با هم مقایسه میکنیم، که شامل +11Na و +19K میشود، از آنجا که +Na و +K در یک گروه جدول تناوبی قرار گرفتهاند، آنها را بر اساس شعاع یونی مقایسه میکنیم، با توجه به اینکه +Na به آرایش الکترونی نئون (10Ne) و +K با آرایش الکترونی آرگون (18Ar) میرسد، پس +Na شعاع یونی کوچکتری نسبت به +K دارد و چون بار هر دو یون برابر (+1) است، پس چگالی بار یونی بیشتر است که شعاع یونی کوچکتری دارد، یعنی: +Na، از آنجایی که آنتالپی فروپاشی با شعاع یونی رابطه عکس دارد، پس آن دو ترکیبی که کاتیون آنها +Na است، آنتالپی فروپاشی بیشتری خواهند داشت، یعنی: NaF, Na2O
در ادامه آنیونها را با هم مقایسه میکنیم که شامل و –F خواهند بود، از آنجایی که فلوئور و اکسیژن در یک دوره قرار گرفتهاند، پس بار آنها مقایسه میکنیم (که چگالی بار با آنتالپی فروپاشی یا نقطه ذوب رابطه مستقیم دارد) و به این صورت خواهد بود: بار اکسیژن (–O2) بیشتر از فلوئور (–F) است، و از آنجایی که اتمهای پشت سر هم در یک دوره هستند، پس شعاع یونی چندان تاثیری ندارد، در نتیجه میتوان گفت چگالی بار –O2 بیشتر از –F میباشد. پس با توجه به آنیونها همانطور که میبینیم، بیشترین چگالی بار مربوط به ترکیبهای K2O و Na2O میباشد و از آنجا که شعاع یونی +Na کمتر از +K بود، پس بیشترین نقطه ذوب یا آنتالپی فروپاشی مربوط به Na2O میباشد.
در پست بعدی بیشتر در مورد شعاع یونی خواهیم آموخت.
یک نظر
ابتدا MgO&MgF2 را مقایسه میکنیم
چون منیزیم اکسید چهار بار دارد نقطه ی ذوب بالاتری دارد
و حالا CaO&CaF2 را مقایسه میکنیم
CaOسه بار دارد و CaF2 دو بار پس نقطه ی ذوب CaO بیشتر است
حال باید CaO &MgO را مقایسه کنیم چون منیزیم و کلسیم در یک گروه قرار دارند باید شعاع اتمی آنها را بررسی کنیم چون در جدول تناوبی کلسیم پایین تر از منیزیم قرار دارد و در یک گروه از بالا به پایین شعاع افزایش می یابد شعاع کلسیم بیشتر است و از آنجایی که برای آنتالپی فروپاشی شعاع آتنی در گروه رابطه ی عکس دارد پس MgO نقطه ی ذوب بیشتری دارد