از آنجایی که واکنشهای سوختن، گرما آزاد میکنند پس همگی گرماده بوده و ΔH<0 میباشد. مانند واکنش سوختن متان:
CH4(g)+2O2(g)→CO2(g)+2H2O(l) ΔH= -890kJ
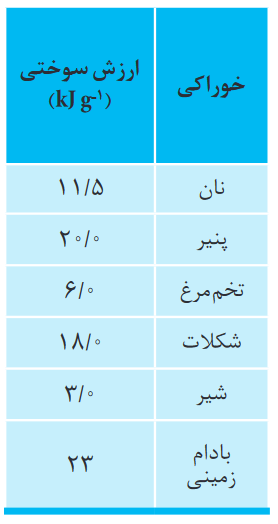
در جدول زیر آنتالپی سوختن چند ترکیب آلی به ازای یک مول از آنها در 25 درجه سانتیگراد آورده شده است:

همان طور که در جدول بالا میبینیم، به ازای سوختن 1 مول از هر ماده، آنتالپی آزاد شده مشخصی وجود دارد، ولی به جای یک مول اگر از یک گرم یک ماده را بسوزانیم به آن ارزش سوختی گوییم، مطابق جدول زیر: