همان طور که در پست سلولهای الکتروشیمی آموختیم، سلولهای الکترولیتی دارای باتری بوده و فقط یک محلول الکترولیت دارند (برخلاف سلولهای گالوانی که دو محلول الکترولیت متفاوت داشتند) و در سلول الکترولیتی، دیگر خبری از پل نمکی یا دیوار متخلخل نیست، همچنین با توجه به نحوه اتصال باتری به الکترودها، در سلول الکترولیتی، آند قطب مثبت و کاتد قطب منفی میباشد
به عنوان مثال اگر بخواهیم سطح یک قاشق از جنس آهن یا مس را نقره اندود کنیم یا سطح آن قاشق را لایهای از نقره قرار دهیم، باید یک الکترود از جنس نقره را در آند که به قطب مثبت باتری متصل است قرار داده و قاشق را در کاتد که به قطب منفی باتری وصل است قرار میدهیم، مطابق شکل زیر:
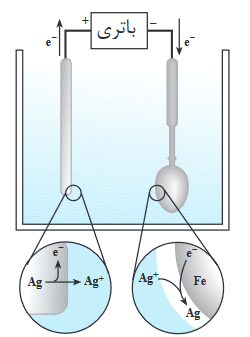
در ابتدا فلز نقره با از دست دادن الکترون اکسایش یافته و تبدیل به یون نقره میشود:
Ag(s)→Ag+(aq)+e– : نیم واکنش آندی
در ادامه یون نقره (+Ag) که یک کاتیون است خود را به کاتد رسانده و واین بار با گرفتن الکترون تبدیل به فلز نقره شده و روی سطح قاشق مینشیند:
Ag+(aq)+e–→Ag(s) : نیم واکنش کاتدی
و بدین صورت لایهای از نقره روی سطح قاشق قرار میگیرد.
با توجه به نیم واکنش آندی و کاتدی مشاهده میکنیم و نقره به طور کلی نه مصرف شده و نه تولید شده، و مقدار آن ثابت مانده است، فقط از الکترود آند به الکترود کاتد منتقل شده است.
یک نظر
طلا باید آند باشد تا با از دست دادن الکترون اکسایش پیدا کند و به یون تبدیل شود