سوال 97 دفترچۀریاضی(سوال 22 شیمی)،اردیبهشت1403
مخلوط a میلیلیتر از محلول اسید قوی HA با (pH=1.4) و b میلیلیتر از محلول همان اسید (pH=1.7)، با 200 میلیلیتر محلول 0.3 مولار سدیم هیدروکسید خنثی میشود. a+b، برابر چند میلیلیتر است؟
1) 500
2) 1000
3) 250
4) 2000
پاسخ:
در ابتدا با استفاده از فرمول: Mα=10-pH مقدار غلظت هر محلول را به دست میآوریم، از آنجایی که HA یک اسید قوی هست، در نتیجه α=1 هست، پس در ابتدا غلظت محلول اول با pH=1.4 را بدست میآوریم:
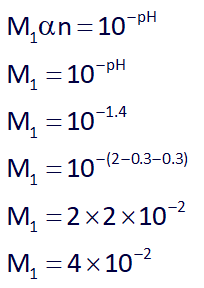
حال غلظت محلول دوم با pH=1.7 را بدست میآوریم:
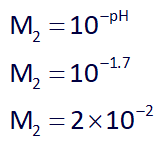
حال با توجه به فرمول واکنش خنثی شدن اسیدها و بازهای قوی تک ظرفیتی، (M1V1=M2V2)، فرض میکنیم a میلیلیتر و b میلیلیتر از حجم مخلوط، فقط از اسید M1 باشد، در نتیجه با وجود 200 میلیلیتر سدیم هیدروکسید 0.3 مولار خواهیم داشت:
4×10-2×(a+b)=0.3×200
a+b=1500 ml
و اگر فقط از اسید M2 استفاده شود، حجم لازم برای خنثی کردن میلیلیتر سدیم هیدروکسید 0.3 مولار برابر است با:
2×10-2×(a+b)=0.3×200
a+b=3000 ml
در نتیجه با مخلوط کردن محلول اسید با غلظت M1 و محلول اسید با غلظت M2، مقدار حجم لازم برای خنثی شدن میلیلیتر سدیم هیدروکسید 0.3 مولار، عددی بین 1500 تا 3000 میلیلیتر خواهد بود، و تنها گزینه که در این محدوده قرار میگیرد 2000 میلیلیتر میباشد.
بنابراین پاسخ گزینۀ 4 هست.
پیش نیاز لازم برای پاسخ به این تست:
- احاطه بر مبحث pH
- احاطه بر مبحث خنثی شدن
تحلیل سوال:
- مبحث اسید و بازها جزو سوالهای همیشگی کنکور بوده که با توجه به مفهومی بودن آن از مباحث مورد علاقه طراحان کنکور است.
بخش زیبای تست:
- میتوان از این تست به عنوان زیباترین تست کنکور اردیبهشت 1403 رشته ریاضی یاد کرد، مختصر، مفهومی، دارای پیشفرض.
بخش دوست نداشتنی تست:
- نداشت، تبریک به طراح خلاق و بادانش این تست
برای دستیابی به نمره 20 امتحان نهایی و درصد بالای کنکور، به اندازۀ یک کلیک فاصله داری.

